A csütörtök délutáni középszintű kémia érettségi feladatsorának kérdéseit is a helyes válaszokat itt találjátok
1. Négyféle asszociáció
Az alábbiakban két rácstípust kell összehasonlítania. Írja be a megfelelő betűjelet a táblázat üres celláiba!
A) Fémrács
B) Ionrács
C) Mindkettő
D) Egyik sem
1. A rácspontokban molekulák vannak.
2. A rácspontokban levő részecskéket elsőrendű kötés tartja össze.
3. E rácsban kristályosodó anyagok vízben általában jól oldódnak.
4. Minden ilyen kristályrácsú anyagban delokalizált elektronok vannak.
5. Elemek kristályrácsa is lehet.
6. Vegyületek kristályrácsa is lehet.
7. E kristályrácsban kristályosodó anyagok olvadéka vezeti az elektromos áramot.
8. E kristályrácsban kristályosodó anyagok között vannak szilárd és folyadék halmazállapotúak is 25 °C-on, standard nyomáson.
9. A glicin kristályrácstípusa.
Megoldás:
1. D
2. C
3. B
4. A
5. A
6. C (B válasz is elfogadható)
7. C
8. A
9. B
2. Esettanulmány
Olvassa el figyelmesen az alábbi szöveget és válaszoljon a kérdésekre!
Zsákállatok növelhetik az óceán szén-dioxid-tartalmát
Az átlátszó, medúzaszerű zsákállatok, az úgynevezett szalpák sokkal fontosabb szerepet tölthetnek be az üvegházhatást okozó szén-dioxid óceáni sorsában, mint korábban gondolták. Egy kutatócsoport vizsgálatai szerint, a körülbelül az emberi hüvelykujj méretével egyenlő szalpák naponta több tonna szenet szállítanak az óceáni felszínről a mélybe, és megakadályozzák, hogy az visszatérjen az atmoszférába. A szalpák – félig áttetsző, hordó alakú állatok – úgy haladnak a vízben, hogy testük elülső részén beszippantják a vizet, majd hátul kilökik, így egyfajta vízsugármeghajtást hoznak létre.
Az óceán elnyeli az atmoszférából származó fölösleges szén-dioxidot. A napsütötte, felszíni vizekben, az apró tengeri lények – fitoplanktonok – a szén-dioxid segítségével fejlődnek. A fitoplanktonokkal táplálkozó állatok felhasználják a szenet, ám annak nagy része visszakerül az óceánba amikor az állatok ürítenek, vagy elpusztulnak. A szenet a baktériumok és a növények újra felhasználhatják, illetve az vissza is juthat az atmoszférába, mint a hőt csapdába ejtő szén-dioxid, amikor az állatok kilélegzik azt. Laurence Madin és Patricia Kremer biológusok, valamint csapatuk négy nyári
expedíciót indítottak az Atlanti-óceánon Cape Hatteras és Georges Bank között 1975-től és rábukkantak egy különleges szalpafajra, a Salpa aspera-ra, mely sűrű rajokban haladt a vízben. Ezek a szalpák cső alakú testükön átengedik az algákat, majd a kiválasztott végterméket széngolyócskák formájában kiengedik magukból, és ezek a golyócskák az óceán fenekére merülnek le. Az egyik raj 100 ezer négyzetkilométernyi vízfelszínt borított be. A kutatók becslései szerint, a raj naponta a felszíni vizek mikroszkopikus, széntartalmú növényeinek 74 százalékát fogyasztotta el, és lesüllyedő ürülékük naponta mintegy 4000 tonna szenet juttatott a mélyebb vizekbe. Arra is rájöttek, hogy amikor egy szalpa elpusztul, teste szintén igen gyorsan süllyed, naponta mintegy 475 métert. Amennyiben pedig a szalpák tényleg zsákutcát jelentenek a táplálékláncban, és maradványaik ott maradnak a tenger fenekén, akkor azzal még több szén jut a mélybe.... ˝
2004-ben és 2006-ban a kutatók különböző ökoszisztémákban vizsgálták meg a szalpákat. Többek között az Antarktisz közeli Déli-óceánban, ugyanis egyes kutatók szerint igen sok szalpa gyűlik ott össze a melegebb időszakokban. Ha az Antarktisz hőmérséklete tényleg emelkedik, és a fentiek igaznak bizonyulnak, a szalpa rajoknak óriási hatása lehet a Déli-óceán fitoplanktonjaira és a tengerben lévő szén mennyiségére.
2006. július 3. 12:26, Hiradó-online cikke alapján
a) A kutatók szerint hogyan jut a levegőben levő szén-dioxid széntartalma az óceán mélyére? (3 lépést írjon!)
b) Mi az a folyamat, amihez a növények a szén-dioxidot használják?
c) A szövegben szereplő adatok alapján egy négyzetkilométernyi területen levő szalparaj naponta átlagosan mekkora tömegű szenet juttat a tenger fenekére?
d) A c) pontban szereplő szén mennyiséghez elvileg mekkora térfogata 25 °C-os, standard nyomású szén-dioxid gáz szükséges?
e) Milyen káros környezeti hatása van a levegő szén-dioxid tartalma növekedésének?
f) A tengerek, óceánok megnövekedett oldott szén-dioxid-tartalma a tengeri élőlényekre (pl. csigákra, korallokra) is veszélyt jelenthet, mert azok házának, vázának mészkőtartalmát kioldhatja. Írja fel ennek a folyamatnak az egyenletét?
g) Helyes-e a fenti szöveg címe? A szalpák valóban a tenger szén-dioxid-tartalmát növelik?
Válaszát indokolja!
Megoldás:
a) Az óceán elnyeli a szén-dioxidot.
Ezt felveszik a fitoplanktonok (növények).Növény → állat → ürülék, illetve elpusztult élőlény, amely lesüllyed az óceán mélyére (vagy ezzel azonos értelmű megfogalmazás).
3. Táblázatos és elemző feladat
Hasonlítsa össze a víz és a benzol tulajdonságait, felhasználva a megadott adatokat!
a) Egészítse ki az alábbi táblázatot!
| víz | benzol | |
| Sűrűség (g/cm3) | 1,00 | 0,874 |
| Olvadáspont (°C) | 0,00 | 5,50 |
| Forráspont (°C) | 100,0 | 80,1 |
| A molekula szerkezeti képlete (a nemkötő elektronpárokat is tüntesse fel) | 1.
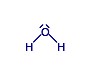
| 2.
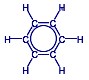
|
| A molekula polaritása | 3. dipólus (poláris) | 4. apoláris |
| A molekulák között létrejövő legerősebb kölcsönhatás (szilárd, illetve folyadék halmazállapotban) | 5. hidrogénkötés | 6. diszperziós kölcsönhatás |
| Halmazállapot 2 °C-on, standard nyomáson | 7. folyadék | 8. szilárd |
| Halmazállapot 102 °C-on, standard nyomáson | 9. gáz | 10. gáz |
b) Ha a vizet és benzolt elegyítünk (szobahőmérsékleten, standard nyomáson), melyik
ábrának megfelelő állapot jön létre? (Válaszát indokolja!)

c) Csoportosítsa az alábbi anyagokat aszerint, hogy melyik oldódik jól benzolban, illetve melyik vízben !
jód, kálium-nitrát, szén-tetraklorid, nátrium-klorid
d) Írja fel egyenlettel, hogyan lép reakcióba a klór a vízzel, illetve – megfelelő
katalizátor alkalmazásakor, enyhe melegítés mellett – benzollal!
Megoldás:
b) A B főzőpohár
a két folyadék nem elegyedik, mert eltérő a polaritásuk és a benzol sűrűsége kisebb, mint a vízé
c)
víz: kálium-nitrát, nátrium-klorid
benzol: jód, szén-tetraklorid
d) víz + klór: H2O + Cl2 = HOCl + HCl
benzol + klór: C6H6 + Cl2 = C6H5Cl + HCl
4. Egyszerű választás
Írja be az egyetlen megfelelő betűjelet a válaszok jobb oldalán található üres cellába!
1. Melyik állítás igaz az elektronegativitásra?
A) Értéke adott periódusban a rendszám növekedésével csökken.
B) Értéke az oszlopon belül a rendszám csökkenésével csökken.
C) A legnagyobb érték a fluorhoz tartozik.
D) Mértékegysége kJ/mol.
E) Apoláris kovalens kötés olyan atomok között jön létre, amelyek elektronegativitásának különbsége nagy.
2. Melyik elem alapállapotú atomja, illetve ionja tartalmaz párosítatlan elektront?
A) Ca
B) S2–
C) S
D) Na+
E) I–
3. Melyik molekula, illetve ion alakja nem tetraéder?
A) metánmolekula
B) ammóniumion
C) diklórmetán
D) szén-tetraklorid
E) formaldehid
4. Melyik állítás igaz a 0,010 mol/dm3 koncentrációjú sósavra?
A) Az oldat pH-ja 2,00.
B) Az oldatot tízszeres térfogatra hígítva, a koncentrációja 0,100 mol/dm3 lesz.
C) Az oldat 1,00 dm3-ét 2,00 dm3 0,020 mol/dm3 koncentrációjú nátrium-hidroxid-oldat közömbösíti.
D) Az oldat 100,0 cm3-e 0,010 mol HCl-ot tartalmaz.
E) Az oldatban: [OH–] = 10–7 mol/dm3.
5. Hogyan állítják elő az iparban az alumíniumot?
A) Az alumínium-oxidot hidrogénnel redukálják.
B) Az alumíniumvegyületek vizes oldatát elektrolizálják.
C) Az alumínium-oxidot szénnel redukálják.
D) Az alumínium-oxidot olvadékban elektrolizálják.
E) Az alumínium-oxidot magas hőmérsékletre hevítve elemeire bontják.
6. Melyik vegyület molekulájában nincs π-kötés?
A) kén-dioxid
B) benzol
C) vinil-klorid
D) szén-dioxid
E) ammónia
7. Az alábbi gázok közül melyik nem káros az egészségre, ha közvetlenül belélegezzük?
A) ózon
B) szén-monoxid
C) klór
D) hidrogén
E) hidrogén-klorid
8. Melyik állítás igaz az alábbiak közül?
A) A galvánelemben elektromos energia alakul kémiai energiává.
B) A reakciósebesség exoterm folyamatok esetén csökken a hőmérséklet növelésével.
C) Az egyensúlyi reakciók a hőmérséklet csökkentésével az exoterm folyamat irányába tolódnak el.
D) Azonos térfogatú és hőmérsékletű gázokban a gáz minőségétől függetlenül ugyanannyi számú atom van.
E) Brönsted-bázisok azok az anyagok, amelyek elektron felvételére képesek.
9. 1,00 dm3 szén-monoxid- és 1,00 dm3 azonos hőmérsékletű és nyomású oxigéngáz elegyének felrobbanását követően a keletkező gázelegy térfogata (a kiindulási hőmérsékleten és nyomáson):
A) 4,00 dm3
B) 3,00 dm3
C) 2,00 dm3
D) 1,50 dm3
E) 1,00 dm3
10. Az alábbi fémek közül melyik nem lép reakcióba sósavval?
A) a vas
B) a réz
C) az alumínium
D) a magnézium
E) a cink
5. Alternatív feladat
A) Elemző feladat
A háztartás vegyületei Az alábbi meghatározásokhoz egy-egy a háztartásban is használt oxigéntartalmú vegyület tartozik. Adja meg a meghatározáshoz tartozó vegyületek képletét és nevét, és válaszoljon a kérdésekre!
a) A fertőtlenítő hatású hypo hatóanyaga:
Mi történik, ha a hypohoz sósavtartalmú vízkőoldót öntünk?
b) A körömlakklemosó is tartalmazza, jó oldószer, nem adja az ezüsttükörpróbát:
Melyik alkohol oxidációjával állíthatjuk elő? Írja fel az oxidáció egyenletét!
c) Ételek savanyítására használják:
Mi a vegyület funkciós csoportjának neve?
d) Fehér, édes, kristályos vegyület, ami adja az ezüsttükörpróbát:
Írja fel az ezüsttükörpróba egyenletét!
Megoldás:
B) Számítási feladat
Az oldódást és a H2O2 bomlását követően hány tömeg%-os lesz a keletkezett oldat nátrium-karbonátra nézve?
Megoldás:
6. Kísérletelemző feladat
a) Ammónia-, etin-, hidrogén-klorid-, illetve szén-dioxid-gázt állítunk elő. Melyik esetben hogyan tartsuk a gázfelfogó edényt? Válaszát indokolja!
b) Mind a négy gáz egy részét vízzel teli kádba vezetve, melyik esetben mit tapasztalunk (teljes mértékben elnyelődik, részben oldódik, nem oldódik)? (A kádban levő víz térfogata kb. 2 dm3, és a reakció során kb. 0,2 mol gáz keletkezik.)
c) A vízben oldódó gáz(ok) vizes oldatához fenolftaleint cseppentve, mit tapasztalunk?
Válaszát indokolja!
d) Mi történik, ha a vízben nem oldódó gáz(oka)t meggyújtjuk?
Megoldás:
a) Szájával lefele: ammónia, etin, szájával felfele: hidrogén-klorid, szén-dioxid.
Indoklás a sűrűségviszonyokkal.
b) Ammónia: teljes mértékben elnyelődik, etin: nem oldódik, hidrogén-klorid: teljes mértékben elnyelődik, szén-dioxid: részben oldódik.
c) Az ammónia vizes oldata lila / vörös / bíbor / ciklámen színű lesz, a hidrogén-klorid vizes oldata színtelen marad, a szén-dioxid vizes oldata színtelen marad.
Indoklás: a fenolftalein lúgos közegben lila / vörös / bíbor / ciklámen színű, (semleges és savas közegben színtelen).
Az ammónia oldata lúgos, a HCl és a CO2 oldata savas kémhatású.
d) Kormozó lánggal ég (az etin).
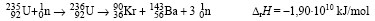
A maghasadás során jelentős mennyiségű energia szabadul fel. A maghasadás során több neutron termelődik, mint amennyi a folyamat megindításánál elhasználódik. A termelődő többletet felhasználhatják újabb magok hasadásának kiváltásához. Megfelelő tömegű 235U esetén a láncreakció önfenntartóvá válik.
Az atomreaktorokban a hasadóanyagból felszabaduló hőt alakítják át elektromos árammá.
Vigyáznak arra, hogy a reaktorban csak a szükséges mennyiségű energia szabaduljon fel, ezért a láncreakciót szabályozzák.
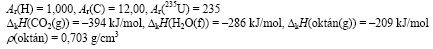
a) Mit nevezünk izotópnak? A fenti szövegből írjon példát izotópokra és adja meg azok proton- és neutronszámát!
Megoldás:
a) Az izotópok azonos rendszámú (protonszámú), de különböző tömegszámú
(neutronszámú) atomok.
235/95U és 236/92U
235/95U : 92 proton, 143 neutron,
236/92U : 92 proton, 144 neutron
Q = 4,26 ⋅ 10–3 mol ⋅ (–1,90⋅1010 kJ/mol) = – 8,09⋅107 kJ
Tehát 8,09⋅107 kJ hő szabadul fel.
M(C8H18) = 114,0 g/mol, n(C8H18) = 703 g / 114,0 g/mol = 6,17 mol
Az égés egyenlete: C8H18(g) + 12,5 O2(g) = 8 CO2(g) + 9 H2O(f)
ΔrH = 8 ⋅ΔkH(CO2(g)) + 9⋅ΔkH(H2O(f)) – ΔkH(C8H18(g))
ΔrH = –3152 – 2574 – (–209) = –5517 kJ/mol
A felszabaduló hőmennyiség: Q = 6,17 mol ⋅ 5517 kJ/mol = 3,40⋅104 kJ
(Ha 1,00 l gázzal számolt:
1/24,5 mol → 225 kJ adódik, ami teljes pontszámot ér.)
(A c) pontban kapott 225 kJ-lal számolva 360 ezer liter benzin adódik.)
8. Elemző és számítási feladat
a) Mi a kiindulási alkén molekulaképlete?
b) Rajzolja fel két nyílt szénláncú konstitúciós izomer szerkezetét (ha van), és adja meg a szabályos elnevezésüket!
c) Írja fel egy olyan konstitúciós izomer szerkezetét, amelyik másik homológ sor tagja!
Mi a vegyület neve?
Megoldás:
a) Az alkén általános képlete: CnH2n
A reakciótermék képlete: CnH2nBr2
M(CnH2n) = 12 n + 2 n = 14n g/mol
M(CnH2nBr2) = 14n + 2⋅79,9 = 14n + 159,8 g/mol
2,90 = (14n +159,8)/14n
n = 6
az alkén molekulaképlete: C6H12 (hexén)
(Bármely más helyes levezetés elfogadható!)
a felírt izomer helyes elnevezése,
a másik izomer helyes felírása:
a felírt izomer helyes elnevezése.
Neve: ciklohexán











